
Système de vecteur Nanoplasmide™ pour l'optimisation de la délivrance génétique
La puissance d'une petite structure pour des thérapies géniques et cellulaires
Système de vecteur Nanoplasmide™
Vous cherchez à améliorer les performances et la fabrication de votre structure ADN, sans vous soucier des questions réglementaires ? La petite structure Nanoplasmide répond à toutes les exigences. Le système de vecteur Nanoplasmide (structure < 500 pb) offre des avantages par rapport aux structures d'ADN plasmidique et aux mini-cercles existants :
- Expression transgénique élevée
- Augmenter les rendements de fabrication
- Améliorer le profil de sécurité en éliminant le gène résistant aux antibiotiques
- Gagner en temps et rentabilité
Alliant les caractéristiques d'une taille réduite et du marqueur de sélection de résistance sans antibiotique RNA-OUT, cette plateforme est parfaitement adaptée à diverses applications thérapeutiques. Aldevron peut fournir de l'ADN Nanoplasmide personnalisé à chaque client.
Avantages des Nanoplasmides selon les applications
| Virus AAV | Lentivirus | Thérapie génique non virale 1,2 | Vaccins à ADN3 | Édition génétique par HDR/CRISPR4,5 | Transposons6 | Protection du vecteur ARNm | |
| Performance | |||||||
| Amélioration de la performance du transgène | • | • | Sans Objet | Sans Objet | |||
| Réduction de la toxicité liée à la transfection | • | • | • | • | • | • | |
| Optimisation de la fabrication | |||||||
| Modèle de plasmide | • | • | • | • | • | ||
| Production du produit final | • | • | • | • | |||
| Conformité réglementaire | |||||||
| Oui | • | • | • | • | • | • | Sans objet |
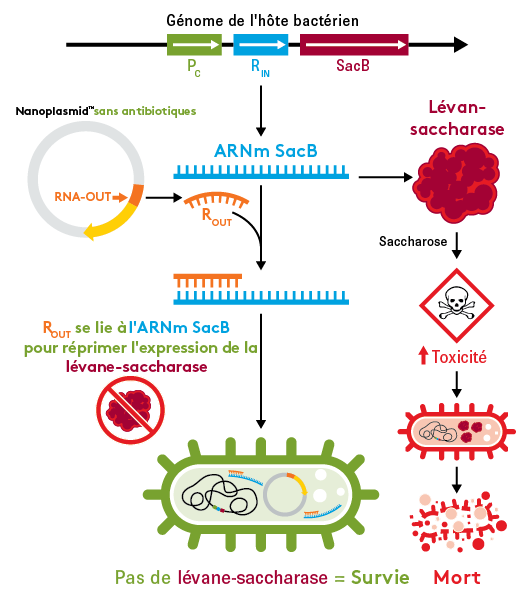
Sélection sans antibiotique assurée par RNA-OUT
La plateforme RNA-OUT fonctionne en réprimant l'expression d'un marqueur contre-sélectif (SacB) du chromosome hôte. Le SacB code pour l'enzyme lévane-saccharase, qui crée un environnement toxique en présence de saccharose, ce qui entraîne la mort cellulaire. La transformation du Nanoplasmide sans antibiotique dans l'hôte exprime un ARN antisens de 150 pb (ROUT) qui se lie à l'ARNm SacB, réprime l'expression de la lévane-saccharase, empêche la toxicité et maintient la survie cellulaire. Le marqueur sélectif RNA-OUT peut être utilisé pour adapter des plasmides ADN de résistance aux antibiotiques existants en un système de contre-sélection de vecteurs sans antibiotiques.
Prenez contact avec votre expert local
Planifiez une consultation avec votre expert local à propos du développement de vos produits Nanoplasmide.
CONTACTER UN SPÉCIALISTE
| region | na1 |
| portalId | 1769030 |
| formId | 74a0b012-b539-42df-8c92-7b4e9c82a414 |
| target | services-hubspot-form |
- Boye C, Arpag S, Francis M, DeClemente S, West A, Heller R, Bulysheva A. Reduction of plasmid vector backbone length enhances reporter gene expression. Bioelectrochemistry. 2022 Apr;144:107981. doi: 10.1016/j.bioelechem.2021.107981.
- Vermeire G, De Smidt E, Geukens N, Williams JA, Declerck P, Hollevoet K. Improved Potency and Safety of DNA-Encoded Antibody Therapeutics Through Plasmid Backbone and Expression Cassette Engineering. Hum Gene Ther. 2021 Oct;32(19–20):1200–1209. doi: https://doi.org/10.1089/hum.2021.105. PMID: 34482757.
- Suschak JJ, Dupuy LC, Shoemaker CJ, Six C, Kwilas SA, Spik KW, et al. Nanoplasmid vectors co-expressing innate immune agonists enhance DNA vaccines for Venezuelan equine encephalitis virus and ebola virus. Molecular Therapy — Methods & Clinical Development.2020;17:810–21.
- Oh SA, Senger K, Madireddi S, Akhmetzyanova I, Ishizuka IE, Tarighat S, et al. High-efficiency nonviral CRISPR/cas9-mediated gene editing of human T cells using plasmid donor DNA. Journal of Experimental Medicine. 2022;219(5). https://doi.org/10.1084/jem.20211530 CC BY 4.0
- Balke-Want H, Keerthi V, Gkitsas N, Mancini AG, Kurgan GL, Fowler C, Xu P, Liu X, et al. Homology-independent targeted insertion (HITI) enables guided CAR knock-in and efficient clinical scale CAR-T cell manufacturing. Mol Cancer. 2023 Jun 26;22(1):100. doi: 10.1186/s12943-023-01799-7.
- Pomeroy EJ, Lahr WS, Chang JW, Krueger J, Wick BJ, Slipek NJ, et al. Non-viral engineering of CAR-NK and CAR-T cells using the TC buster transposon system™. bioRxiv 2021.08.02.454772; doi: https://doi.org/10.1101/2021.08.02.454772 23-Nanoplasmid-
